ilinp
Порфирии 1 ( 5 фото )
Сохраню для памяти, я бы скомпоновал по другому, начав с наиболее часто встречающегося, но пусть и так..
Порфирии являются группой метаболических заболеваний, вызванных нарушениями (обычно генетической природы) в активности конкретных ферментов биосинтеза гема, приводящими к сверхсинтезу и накоплению промежуточных продуктов. Промежуточные продукты, которые накапливаются, включают порфирины и предшественников порфиринов — дельта-аминолевулиновую кислоту и порфобилиногена и их производных. Клиника болезни проявляется при токсических концентрациях. Образцы этих веществ в плазме, эритроцитах, моче и фекалиях характерны для каждой порфирии и являются основой для скрининговых тестов и более полной биохимической характеристики болезни [3].
Биосинтез гема включает 8 ферментативных стадий в превращении глицина и сукцинил-коэнзима в гем. Первый и последние 3 фермента в пути находятся в митохондрии, тогда как другие 4 находятся в цитозоле (рис. 1).

Рисунок 1.
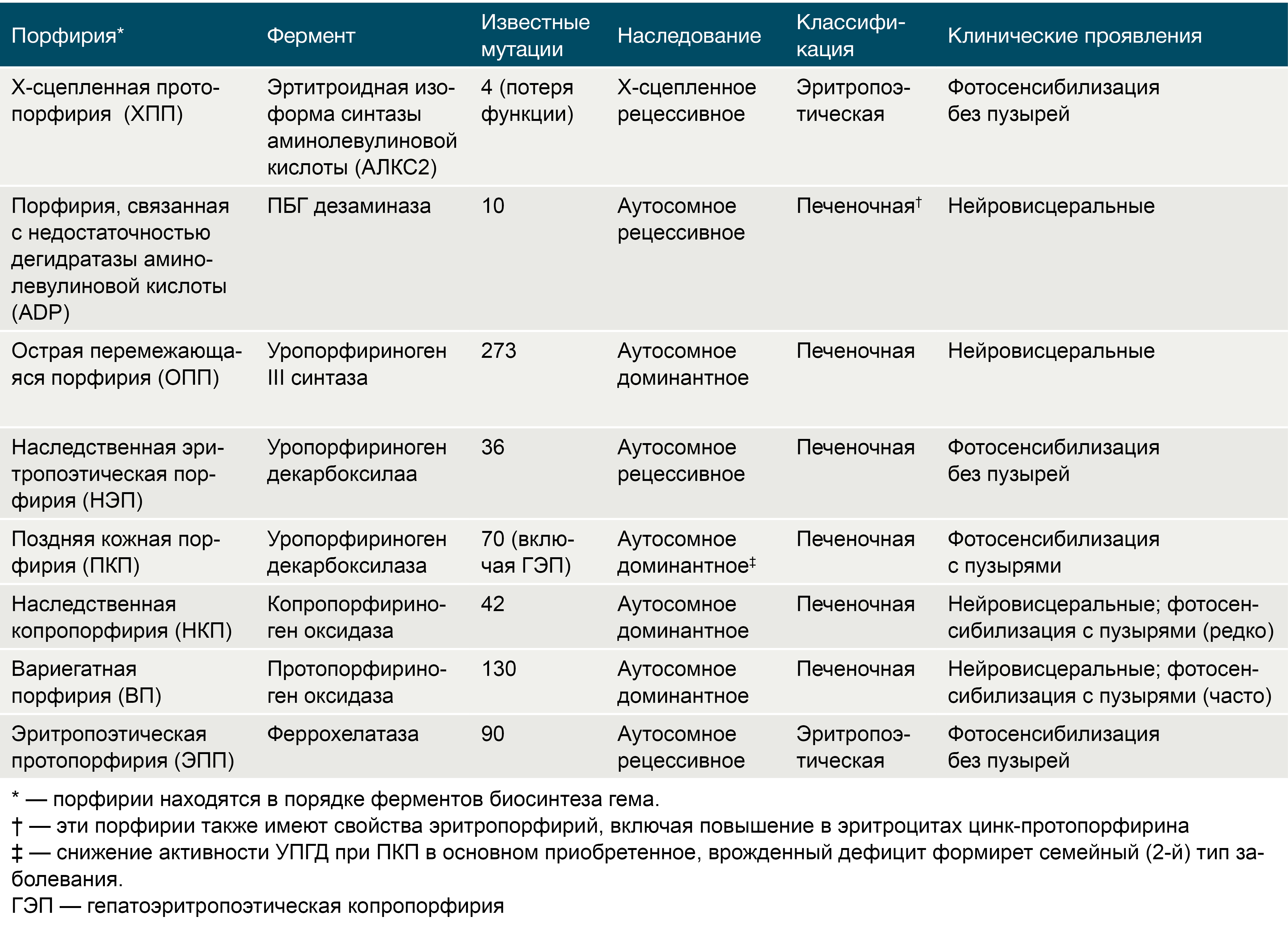
Они кодируются 9 генами, т.к. первый фермент — дельта-аминолевулинатсинтаза имеет 2 гена, которые кодируют уникальные печёночный (housekeeping) и костномозговой изоферменты, ALAS1 и ALAS2 соответственно. Все эти гены были клонированы, и мутации в них были идентифицированы (таб. 1).
Таблица 1.
Обратная негативная связь является важной частью регуляции биосинтеза гема в печени. Гем с помощью белка репрессора связывается с ДНК, что приводит к подавлению транскрипции и прекращению синтеза аминолевулинатсинтазы (ALAS1), скорость-лимитирующего фермента в биосинтезе гема. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, сульфаниламиды, стероиды, НПВС, барбитураты) — при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента. Что касается костного мозга, то здесь регуляция осуществляется с помощью ионов железа. Железо, связываясь с особым железосвязывающим белком, инициирует синтез костномозгового изофермента ALAS2, то есть оказывает положительный эффект (рис. 2).
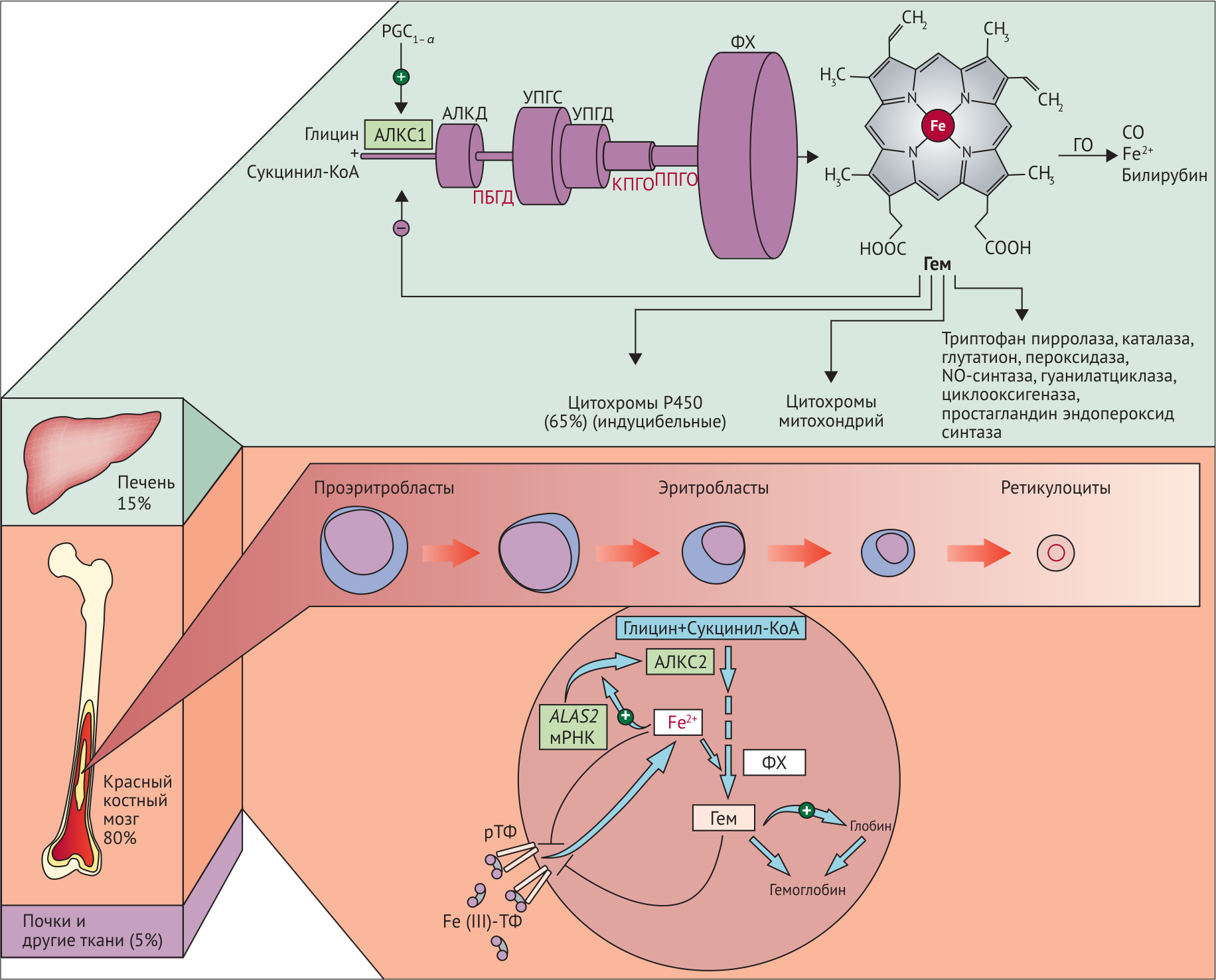
Рисунок 2.
Порфирии классифицируются как эритропоэтические или печёночные в зависимости от места синтеза и накопления промежуточных продуктов метаболизма гема.
Эритропоэтические порфирии — это врождённая эритропоэтическая порфирия (порфирия Гюнтера), эритропоэтическая протопорфирия и X-сцепленная протопорфирия, которая широко распространена, особенно среди детей. Печёночные порфирии включают острые порфирии (их 4), которые вызывают неврологические симптомы, обычно в виде острых приступов, и позднюю кожную порфирию, которая является наиболее распространённой из порфирий. Острые порфирии включают порфирию, обусловленную дефицитом дегидратазы аминолевулиновой кислоты, острую перемежающуюся порфирию, наследственную копропорфирию и вариегатную порфирию. Все формы острой порфирии наследуются аутосомно-доминантно и имеют низкую (около 10%) пенетрантность, что указывает на то, что мутация по крайней мере в одном ферменте биосинтеза гема важна, но недостаточна для клинического проявления заболевания. Необходимо задействовать некоторые дополнительные генетические факторы, которые необходимы для патологического фенотипа у гетерозиготных носителей мутантного гена [1,3].
Врождённая эритропоэтическая порфирия (болезнь Гюнтера).
Это аутосомно-рецессивное генетическое заболевание, характеризуемое заметно сниженной ферментативной активностью уропорфироген-III-синтазы, четвёртого фермента в пути биосинтеза гема. Дефекты uros, гена, кодирующего этот фермент, являются чрезвычайно гетерогенными на молекулярном уровне. Известны по меньшей мере 36 различных мутаций этого гена, а также одна мутация GATA-1 (кодирует эритроидный фактор транскрипции). Болезнь характеризуется гиперсинтезом уропорфирина I, который проявляется при рождении и в неонатальном периоде. Уропорфирогенсинтаза катализирует превращение гидроксиметилбилана (ГМБ), линейного тетрапиррола, в циклический тетрапиррол — уропорфириноген III. В отсутствие этого фермента ГМБ подвергается спонтанному замыканию кольца до уропорфириногена I, который может быть дополнительно метаболизирован только до копропорфириногена I. Они спонтанно окисляются до уропорфирина и копропорфирина, которые являются фотосенсибилизирующими порфиринами и вызывают кожные проявления этой патологии [4].
Клиника болезни может варьироваться в зависимости от тяжести унаследованных мутаций uros и уровня порфиринов в плазме и эритроцитах. Тяжёлое заболевание может проявлять себя ещё во внутриутробном периоде (неиммунная водянка плода) или вскоре после рождения выделением красной мочи, сильной фоточувствительностью, гемолитической анемией, спленомегалией и эритродонтией (рис. 3). Повторное воздействие солнечного света может привести к образованию рубцов, инфекции. Изменения со стороны скелета могут быть результатом дефицита витамина D. Характерные субэпидермальные буллёзные поражения прогрессируют и образуют корковые эрозии, заживающие с образованием рубцов и участков гипер- и гипопигментации. Также распространённым является гипертрихоз и алопеция. Потеря черт лица и пальцев встречаются часто и являются результатом рецидивирующих пузырей, инфекций и рубцевания [3,4].
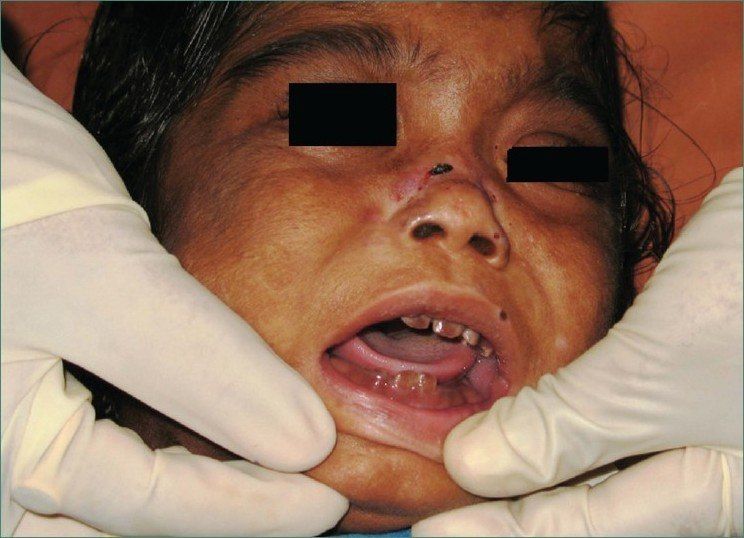
Рисунок 3.
Диагноз часто ставится после рождения, когда начинается тяжёлая фотосенсибилизация и окрашивание мочи в красный цвет. Для подтверждения диагноза исследуют ДНК для выявления причинных мутаций. Это особенно важно для генетического консультирования и для пренатальной диагностики в последующей беременности. Болезнь Гюнтера следует дифференцировать от других поражений кожи (солнечная эритема, травмы, аллергические, инфекционные поражения и др.). Для этого используют различные биохимические тесты и флуоресцентную спектроскопию (таб. 2).
Лечение начинается с защитных мер от солнца. Следует соблюдать осторожность, чтобы избежать травм кожи; и раннее лечение кожных инфекций является оправданным. Длительная трансфузионная терапия устраняет анемию и эффективно подавляют эритропоэз. Однако они могут привести к избытку железа, что может потребовать парентерального дефероксамина или орально-активных хелаторов железа, деферазирокса или деферипрона. Более инвазивные процедуры, такие как спленэктомия, были направлены на снижение гемолиза, но долгосрочная эффективность по-прежнему вызывает сомнение. Трансплантация гемопоэтических стволовых клеток — это метод выбора, когда имеется подходящий донор, особенно для молодых пациентов. При успешной трансплантации наблюдается заметное улучшение состояния больного и снижение уровней порфирина, даже если они не полностью нормализуются [3,4].
Эритропоэтическая протопорфирия (ЭПП).
ЭПП также является наследственным нарушением, характеризующимся накоплением протопорфирина в крови, эритроцитах и тканях, что приводит к болезненной фоточувствительности. Сообщается, что во всём мире она распространена с частотой от 1:75000 до 1:200000. Важной особенностью ЭПП является то, что она отличается широкой распространённостью среди детей.
Классическая ЭПП возникает в результате наследования мутантного аллеля fech, кодирующего феррохелатазу, которая катализирует включение железа в кольцо протопорфирина для получения гема. Феррохелатаза также катализирует включение цинка в это кольцо с образованием цинк-протопорфирина из любого протопорфирина, который остаётся после завершения синтеза гема. При ЭПП безметалловый протопорфирин накапливается в ретикулоцитах костного мозга, поскольку нарушается образование как гема, так и цинк-протопорфирина. Безметалловый протопорфирин поступает в плазму из костного мозга и циркулирующих эритроцитов, а затем переносится на кожу, вызывая фоточувствительность, и в печень для экскреции с желчью. Более 130 идентифицированных мутаций в гене, находящемся в 18-й хромосоме, относятся к мутациям с потерей функций. Совсем недавно было обнаружено, что у 5‒10% пациентов с типичным фенотипом ЭПП Х-сцепленно передаётся мутантный ген Alas2, и сейчас этот вариант ЭПП называют Х-сцепленной протопорфирией [4].
Накопление жирорастворимого свободного протопорфирина в коже и кожных кровеносных сосудах и последующая фотоактивация солнечным светом приводят к характерным кожным проявлениям ЭПП. У детей с этим расстройством развиваются боль, покраснение, отёк и зуд в течение нескольких минут после воздействия солнечного света. Эти симптомы могут длиться от нескольких часов до нескольких дней. В отличие от болезни Гюнтера, везикулы и буллы нехарактерны, встречаются только в 10% случаев. Хронические изменения кожи, такие как лихенизация и псевдовезикулы, могут развиться после повторных эпизодов фоточувствительности. Они наиболее заметны в скуловой области и кисти рук. Также могут развиться различные гепатобилиарные осложнения. Обструкция жёлчевыводящих путей жёлчными камнями, в состав которых входит протопорфирин, наблюдается у 20% пациентов. У 3‒5% пациентов снижение оттока желчи может привести к пигментному циррозу.
Наблюдается умеренная гипохромная анемия с микроцитозом. Уровень сывороточного железа и растворимых рецепторов трансферрина не изменяется. Нейровисцеральные проявления могут быть у пациентов с осложнённой ЭПП (гепатопатия), у которых развиваются двигательные нейропатии, аналогичные той, которая наблюдалась в острых порфириях.
Проводят биохимические тесты для определения уровня протопорфирина в плазме и эритроцитах, потому что при ЭПП наблюдается заметное повышение уровня протопорфирина. Поскольку протопорфирин не выводится с мочой, уровни предшественников порфирина в моче являются нормальными. Для подтверждения диагноза возможен анализ генов fech и Alas2. Дополнительно исследуют гепатобилиарную функцию в прогностических целях.
Как и при болезни Гюнтера, защитные меры от солнца являются неотъемлемой частью ведения пациентов с ЭПП. Пациентам назначается аналог альфа-меланоцитстимулирующего гормона (афамеланотид). При наличии осложнений со стороны печени рекомендуют секвестранты жёлчных кислот (холестирамин по 4‒16 г/сут) и желчегонные — уродезоксихолевую кислоту.
Порфирия, обусловленная дефицитом дегидратазы аминолевулиновой кислоты.
Это очень редкое аутосомно-рецессивное заболевание, вызванное серьёзным дефицитом аминолевулинатдегидратазы (порфобилиногенсинтазы). Этот фермент катализирует образование порфобилиногена из двух молекул аминолевулината. Фермент кодируется геном alad, локализованным на хромосоме 9q34. Для полной активности фермента требуется сульфгидрильная группа и один атом цинка на субъединицу (всего 8 одинаковых субъединиц). Из-за дефицита фермента уровень аминолевулината существенно повышается в плазме и моче у пациентов с этой болезнью. ALA дополнительно метаболизируется с образованием других предшественников гема, и в результате копропорфирин III выделяется с мочой в больших количествах, а количество протопорфирина IX увеличивается в эритроцитах. Следует сказать, что, как и в других острых порфириях, механизм неврологического повреждения недостаточно изучен [3,4].
На сегодняшний день зарегистрировано всего 6 случаев этой болезни. В 4 случаях симптомы манифестировали только в подростковом периоде. У больных наблюдались нейровисцеральные симптомы и отсутствовали кожные проявления, что является характерной особенностью острых порфирий.
При лабораторной диагностике определяется недостаточная активность дефектного фермента, выраженное повышение уровня копропорфирина III в моче.
Дифференциальная диагностика должна включать другие печёночные порфирии, отравление свинцом, наследственную тирозинемию 1 типа, в которых подавляется активность аминолевулинатдегидратазы.
Поскольку было зарегистрировано всего несколько случаев, рекомендации по лечению основаны на ограниченном опыте. На данный момент используется гемин, который в какой-то степени улучшает клиническую картину. Он по механизму отрицательной обратной связи устраняет дефицит гема, подавляет активность синтазы дельта-аминолевулиновой кислоты — ключевого фермента синтеза порфиринов, в результате чего уменьшается синтез порфиринов и токсичных метаболических предшественников гема. Таким образом гемин осуществляет коррекцию патофизиологических нарушений, сопровождающих порфирию.
Продолжение следует...

Порфирии являются группой метаболических заболеваний, вызванных нарушениями (обычно генетической природы) в активности конкретных ферментов биосинтеза гема, приводящими к сверхсинтезу и накоплению промежуточных продуктов. Промежуточные продукты, которые накапливаются, включают порфирины и предшественников порфиринов — дельта-аминолевулиновую кислоту и порфобилиногена и их производных. Клиника болезни проявляется при токсических концентрациях. Образцы этих веществ в плазме, эритроцитах, моче и фекалиях характерны для каждой порфирии и являются основой для скрининговых тестов и более полной биохимической характеристики болезни [3].
Биосинтез гема включает 8 ферментативных стадий в превращении глицина и сукцинил-коэнзима в гем. Первый и последние 3 фермента в пути находятся в митохондрии, тогда как другие 4 находятся в цитозоле (рис. 1).

Рисунок 1.
Они кодируются 9 генами, т.к. первый фермент — дельта-аминолевулинатсинтаза имеет 2 гена, которые кодируют уникальные печёночный (housekeeping) и костномозговой изоферменты, ALAS1 и ALAS2 соответственно. Все эти гены были клонированы, и мутации в них были идентифицированы (таб. 1).
Таблица 1.

Обратная негативная связь является важной частью регуляции биосинтеза гема в печени. Гем с помощью белка репрессора связывается с ДНК, что приводит к подавлению транскрипции и прекращению синтеза аминолевулинатсинтазы (ALAS1), скорость-лимитирующего фермента в биосинтезе гема. В печени повышение активности аминолевулинатсинтазы вызывают соединения, усиливающие работу микросомальной системы окисления (жирорастворимые токсины, сульфаниламиды, стероиды, НПВС, барбитураты) — при этом возрастает потребление гема для образования цитохрома Р450, что снижает внутриклеточную концентрацию свободного гема. В результате происходит дерепрессия синтеза фермента. Что касается костного мозга, то здесь регуляция осуществляется с помощью ионов железа. Железо, связываясь с особым железосвязывающим белком, инициирует синтез костномозгового изофермента ALAS2, то есть оказывает положительный эффект (рис. 2).

Рисунок 2.
Порфирии классифицируются как эритропоэтические или печёночные в зависимости от места синтеза и накопления промежуточных продуктов метаболизма гема.
Эритропоэтические порфирии — это врождённая эритропоэтическая порфирия (порфирия Гюнтера), эритропоэтическая протопорфирия и X-сцепленная протопорфирия, которая широко распространена, особенно среди детей. Печёночные порфирии включают острые порфирии (их 4), которые вызывают неврологические симптомы, обычно в виде острых приступов, и позднюю кожную порфирию, которая является наиболее распространённой из порфирий. Острые порфирии включают порфирию, обусловленную дефицитом дегидратазы аминолевулиновой кислоты, острую перемежающуюся порфирию, наследственную копропорфирию и вариегатную порфирию. Все формы острой порфирии наследуются аутосомно-доминантно и имеют низкую (около 10%) пенетрантность, что указывает на то, что мутация по крайней мере в одном ферменте биосинтеза гема важна, но недостаточна для клинического проявления заболевания. Необходимо задействовать некоторые дополнительные генетические факторы, которые необходимы для патологического фенотипа у гетерозиготных носителей мутантного гена [1,3].
Врождённая эритропоэтическая порфирия (болезнь Гюнтера).
Это аутосомно-рецессивное генетическое заболевание, характеризуемое заметно сниженной ферментативной активностью уропорфироген-III-синтазы, четвёртого фермента в пути биосинтеза гема. Дефекты uros, гена, кодирующего этот фермент, являются чрезвычайно гетерогенными на молекулярном уровне. Известны по меньшей мере 36 различных мутаций этого гена, а также одна мутация GATA-1 (кодирует эритроидный фактор транскрипции). Болезнь характеризуется гиперсинтезом уропорфирина I, который проявляется при рождении и в неонатальном периоде. Уропорфирогенсинтаза катализирует превращение гидроксиметилбилана (ГМБ), линейного тетрапиррола, в циклический тетрапиррол — уропорфириноген III. В отсутствие этого фермента ГМБ подвергается спонтанному замыканию кольца до уропорфириногена I, который может быть дополнительно метаболизирован только до копропорфириногена I. Они спонтанно окисляются до уропорфирина и копропорфирина, которые являются фотосенсибилизирующими порфиринами и вызывают кожные проявления этой патологии [4].
Клиника болезни может варьироваться в зависимости от тяжести унаследованных мутаций uros и уровня порфиринов в плазме и эритроцитах. Тяжёлое заболевание может проявлять себя ещё во внутриутробном периоде (неиммунная водянка плода) или вскоре после рождения выделением красной мочи, сильной фоточувствительностью, гемолитической анемией, спленомегалией и эритродонтией (рис. 3). Повторное воздействие солнечного света может привести к образованию рубцов, инфекции. Изменения со стороны скелета могут быть результатом дефицита витамина D. Характерные субэпидермальные буллёзные поражения прогрессируют и образуют корковые эрозии, заживающие с образованием рубцов и участков гипер- и гипопигментации. Также распространённым является гипертрихоз и алопеция. Потеря черт лица и пальцев встречаются часто и являются результатом рецидивирующих пузырей, инфекций и рубцевания [3,4].

Рисунок 3.
Диагноз часто ставится после рождения, когда начинается тяжёлая фотосенсибилизация и окрашивание мочи в красный цвет. Для подтверждения диагноза исследуют ДНК для выявления причинных мутаций. Это особенно важно для генетического консультирования и для пренатальной диагностики в последующей беременности. Болезнь Гюнтера следует дифференцировать от других поражений кожи (солнечная эритема, травмы, аллергические, инфекционные поражения и др.). Для этого используют различные биохимические тесты и флуоресцентную спектроскопию (таб. 2).
Лечение начинается с защитных мер от солнца. Следует соблюдать осторожность, чтобы избежать травм кожи; и раннее лечение кожных инфекций является оправданным. Длительная трансфузионная терапия устраняет анемию и эффективно подавляют эритропоэз. Однако они могут привести к избытку железа, что может потребовать парентерального дефероксамина или орально-активных хелаторов железа, деферазирокса или деферипрона. Более инвазивные процедуры, такие как спленэктомия, были направлены на снижение гемолиза, но долгосрочная эффективность по-прежнему вызывает сомнение. Трансплантация гемопоэтических стволовых клеток — это метод выбора, когда имеется подходящий донор, особенно для молодых пациентов. При успешной трансплантации наблюдается заметное улучшение состояния больного и снижение уровней порфирина, даже если они не полностью нормализуются [3,4].
Эритропоэтическая протопорфирия (ЭПП).
ЭПП также является наследственным нарушением, характеризующимся накоплением протопорфирина в крови, эритроцитах и тканях, что приводит к болезненной фоточувствительности. Сообщается, что во всём мире она распространена с частотой от 1:75000 до 1:200000. Важной особенностью ЭПП является то, что она отличается широкой распространённостью среди детей.
Классическая ЭПП возникает в результате наследования мутантного аллеля fech, кодирующего феррохелатазу, которая катализирует включение железа в кольцо протопорфирина для получения гема. Феррохелатаза также катализирует включение цинка в это кольцо с образованием цинк-протопорфирина из любого протопорфирина, который остаётся после завершения синтеза гема. При ЭПП безметалловый протопорфирин накапливается в ретикулоцитах костного мозга, поскольку нарушается образование как гема, так и цинк-протопорфирина. Безметалловый протопорфирин поступает в плазму из костного мозга и циркулирующих эритроцитов, а затем переносится на кожу, вызывая фоточувствительность, и в печень для экскреции с желчью. Более 130 идентифицированных мутаций в гене, находящемся в 18-й хромосоме, относятся к мутациям с потерей функций. Совсем недавно было обнаружено, что у 5‒10% пациентов с типичным фенотипом ЭПП Х-сцепленно передаётся мутантный ген Alas2, и сейчас этот вариант ЭПП называют Х-сцепленной протопорфирией [4].
Накопление жирорастворимого свободного протопорфирина в коже и кожных кровеносных сосудах и последующая фотоактивация солнечным светом приводят к характерным кожным проявлениям ЭПП. У детей с этим расстройством развиваются боль, покраснение, отёк и зуд в течение нескольких минут после воздействия солнечного света. Эти симптомы могут длиться от нескольких часов до нескольких дней. В отличие от болезни Гюнтера, везикулы и буллы нехарактерны, встречаются только в 10% случаев. Хронические изменения кожи, такие как лихенизация и псевдовезикулы, могут развиться после повторных эпизодов фоточувствительности. Они наиболее заметны в скуловой области и кисти рук. Также могут развиться различные гепатобилиарные осложнения. Обструкция жёлчевыводящих путей жёлчными камнями, в состав которых входит протопорфирин, наблюдается у 20% пациентов. У 3‒5% пациентов снижение оттока желчи может привести к пигментному циррозу.
Наблюдается умеренная гипохромная анемия с микроцитозом. Уровень сывороточного железа и растворимых рецепторов трансферрина не изменяется. Нейровисцеральные проявления могут быть у пациентов с осложнённой ЭПП (гепатопатия), у которых развиваются двигательные нейропатии, аналогичные той, которая наблюдалась в острых порфириях.
Проводят биохимические тесты для определения уровня протопорфирина в плазме и эритроцитах, потому что при ЭПП наблюдается заметное повышение уровня протопорфирина. Поскольку протопорфирин не выводится с мочой, уровни предшественников порфирина в моче являются нормальными. Для подтверждения диагноза возможен анализ генов fech и Alas2. Дополнительно исследуют гепатобилиарную функцию в прогностических целях.
Как и при болезни Гюнтера, защитные меры от солнца являются неотъемлемой частью ведения пациентов с ЭПП. Пациентам назначается аналог альфа-меланоцитстимулирующего гормона (афамеланотид). При наличии осложнений со стороны печени рекомендуют секвестранты жёлчных кислот (холестирамин по 4‒16 г/сут) и желчегонные — уродезоксихолевую кислоту.
Порфирия, обусловленная дефицитом дегидратазы аминолевулиновой кислоты.
Это очень редкое аутосомно-рецессивное заболевание, вызванное серьёзным дефицитом аминолевулинатдегидратазы (порфобилиногенсинтазы). Этот фермент катализирует образование порфобилиногена из двух молекул аминолевулината. Фермент кодируется геном alad, локализованным на хромосоме 9q34. Для полной активности фермента требуется сульфгидрильная группа и один атом цинка на субъединицу (всего 8 одинаковых субъединиц). Из-за дефицита фермента уровень аминолевулината существенно повышается в плазме и моче у пациентов с этой болезнью. ALA дополнительно метаболизируется с образованием других предшественников гема, и в результате копропорфирин III выделяется с мочой в больших количествах, а количество протопорфирина IX увеличивается в эритроцитах. Следует сказать, что, как и в других острых порфириях, механизм неврологического повреждения недостаточно изучен [3,4].
На сегодняшний день зарегистрировано всего 6 случаев этой болезни. В 4 случаях симптомы манифестировали только в подростковом периоде. У больных наблюдались нейровисцеральные симптомы и отсутствовали кожные проявления, что является характерной особенностью острых порфирий.
При лабораторной диагностике определяется недостаточная активность дефектного фермента, выраженное повышение уровня копропорфирина III в моче.
Дифференциальная диагностика должна включать другие печёночные порфирии, отравление свинцом, наследственную тирозинемию 1 типа, в которых подавляется активность аминолевулинатдегидратазы.
Поскольку было зарегистрировано всего несколько случаев, рекомендации по лечению основаны на ограниченном опыте. На данный момент используется гемин, который в какой-то степени улучшает клиническую картину. Он по механизму отрицательной обратной связи устраняет дефицит гема, подавляет активность синтазы дельта-аминолевулиновой кислоты — ключевого фермента синтеза порфиринов, в результате чего уменьшается синтез порфиринов и токсичных метаболических предшественников гема. Таким образом гемин осуществляет коррекцию патофизиологических нарушений, сопровождающих порфирию.
Продолжение следует...
Взято: Тут
410















